Die Delegierte Verordnung (EU) 2016/161 der Kommission zur Ergänzung der Richtlinie 2001/83/EG zur Verhinderung des Eindringen von gefälschten Arzneimitteln in die legale Lieferkette erfordert ein „individuelles Erkennungsmerkmal“ zur Identifizierung und Feststellung der Echtheit, sowie die Anbringung einer „Vorrichtung zur Erkennung von Manipulation“ für alle verschreibungspflichtigen Arzneimittel.
“In Deutschland muss die delegierte Verordnung (EU) 2016/161 zur Fälschungsschutzrichtlinie 2001/83/EG bis zum Februar 2019 umgesetzt sein“
Pharma (EU 2016/161)
Gesetzliche Anforderung an den pharmazeutischen Unternehmer
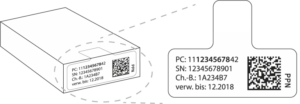

Seit dem 9. Februar 2019 muss nun in der Europäischen Union (und zusätzlich in den Ländern des Europäischen Wirtschaftsraums (EWR), zu dem beispielsweise die Schweiz und Norwegen gehören) jede Packung eines verschreibungspflichtigen Medikaments manipulationssicher gestaltet und mit einem nur einmal vorhandenen Code versehen sein, der bei Abgabe der Packung durch eine Apotheke gegen eine nationale und EU-weite Datenbank in Echtzeit abgeglichen wird. Ist der Code auf der Packung in der zentralen Datenbank als „verbraucht“ gekennzeichnet, darf die Packung nicht abgegeben werden. Denn in diesem Fall besteht ein Fälschungsverdacht. Die Ampel innerhalb des Kontrollprozesses springt auf Rot und es muss der Ursache des doppelten Codes nachgegangen werden.
Nicht wenige pharmazeutische Unternehmen sind unzureichend gerüstet
Der Vorgang, den die EU-Verordnung 2016/161 zur Fälschungssicherheit verschreibungspflichtiger Arzneimittel vorgibt, scheint auf den ersten Blick simpel, hat es aber technisch und organisatorisch in sich. Der entsprechende Verifikationsprozess erfordert nämlich mehrere Kompetenzen gleichzeitig: hochkarätige Drucktechnik für die Codeaufbringung, präzise Kameratechnik für die Inspektion des Codes und umfangreiche Software für die Datenerzeugung, die Datenverwaltung- und Archivierung sowie die Validierung der Prozesse und die Datensicherheit. Dazu kommt, dass der Serialisierungsprozess sowohl in die Verpackungslinie und die entsprechenden ERP- und Warenwirtschaftssysteme als auch in die Datenübertragung zur nationalen und europäischen Verifikations-Datenbank integriert werden muss.
Auch die Anforderungen an Verpackungen ändern sich, da das Aufbringen des Data-Matrix-Codes an der Linie typischer Weise eine Lackfreifläche erfordert. Hinzu kommen Veränderungen am Packungsdesign für die Anbringung des Sicherheitsverschlusses.
Wie pharmazeutische Betriebe auch nach dem 9. Februar 2019 im Geschäft bleiben können
Es ist ein offenes Geheimnis, dass nicht wenige pharmazeutische Unternehmen die mit der EU-Verordnung einhergehende Komplexität der Anforderungen unterschätzt haben und nur unzulänglich für den Stichtag im Februar 2019 gerüstet sind. Viele Unternehmen werden die Herausforderungen in ihrer ganzen Härte wohl erst am Stichtag und in den Wochen danach, wenn die letzten nicht-serialisierten Packungen verkauft sind, zu spüren bekommen.
Dienstleister in Sachen Serialisierung und Manipulationsschutz sind dann die letzte Rettung, sollten allerdings schon vorher kontaktiert und beauftragt werden. Nur so können die pharmazeutischen Unternehmen bei verschreibungspflichtigen Arzneimitteln nach dem 9. Februar 2019 im Geschäft bleiben.
Mit Haftetiketten schlägt man zwei Fliegen mit einer Klappe
Für ein umfassendes Dienstleistungsangebot zur Erfüllung der Delegierten Verordnung EU 2016/161 eignen sich Haftetiketten besonders gut. Sie lassen sich schnell und effizient kundenspezifisch konfektionieren und verschicken. Beim Druck direkt auf Faltschachteln gestaltet sich ein entsprechender Dienstleistungsprozess sehr viel schwieriger. Überdies können professionelle Haftetiketten gleichzeitig als Erstöffnungsschutz eingesetzt werden. Es ist erfreulich, dass die Ausführungsbestimmungen der Delegierten Verordnung EU 2016/161 den Einsatz von Etiketten zwar nicht als Standard vorsehen, aber in einem genau definierten Rahmen zulassen. In der Veröffentlichung „Safety Features for Medicinal Products für Human Use“, Questions & Answers, Version 12 vom November 2018 heißt es unter anderem:
„Placing the unique identifier by means of stickers can be accepted in the following circumstances:
Competent national authorities authorise it due to the marketing authorisation, including for parallel import, or to safeguard public health and ensure continued supply.
(https://ec.europa.eu/health/sites/health/files/files/falsified_medicines/qa_safetyfeature_en.pdf)

